Duới đây là các thông tin và kiến thức về Các nguyên tố halogen hot nhất được tổng hợp bởi M & Tôi
nhóm halogen bao gồm những nguyên tố nào và chúng nằm ở vị trí nào trong bảng tuần hoàn các nguyên tố hóa học? tính chất hóa học của các nguyên tố halogen là gì? cùng mono tìm hiểu chi tiết trong bài tổng hợp dưới đây của mono.
nhóm halogen là gì? vị trí của nhóm halogen trong bảng tuần hoàn
nhóm halogen còn thường được gọi là các nguyên tố halogen (tiếng Latinh được hiểu là sinh ra muối). nhóm halogen bao gồm các nguyên tố flo (f), br (brom), clo (cl), iot (i) và reach (at). atatin không gặp trong tự nhiên, nó ược điều chế nhân tạo trong các lò phản ứng hạt nhân nên ược xem xét chủ yếu trong các nhÓm nguyên tỡ. nhóm nguyên tố halogen bao gồm các nguyên tố phi kim phản ứng tạo thành các hợp chất có títh axit mạnh với hiđro từ đó các muối ơn giản c The ể ể ạ ạ ạ ạ ể
những nguyên tố halogen thuộc nhóm viia. chúng đứng ở cuối các chu kì, ngay trước các nguyên tố khí hiếm.
cấu tạo phân tử của nhóm halogen
lớp electron ngoài cùng nguyên tử các nguyên tố halogen đều có 7 electron, được chia thành 2 phân lớp: phân lớp s có 2 electron, phân lớp p có 5 electron. do 7 electron ngoài cùng, chỉ còn thiếu 1 electron là ạt ược cấu hình của khí hiếm, do vậy ở Trạng that tự do hai nguyên tử halogen gip chung một đi electron ctt ctt cavil (x -x hoặc x2, x là ký hiệu chỉ các nguyên tố halogen).
liên kết của các phân tử x2 không bền, chúng thường bị tách ra thành 2 nguyên tử x. trong phản ứng hóa học, các nguyên tử này rất hoạt động vì chúng dễ thu thêm 1 electron. bởi vậy mà tính chất hóa học cơ bản của nhóm halogen là tính oxi hóa mạnh.
tính chất vật lý của nhóm halogen
tìm hiểu tính chất vật lý của nhóm halogen, chung ta sẽ ềp ến trạng thati, màu sắc, nhiệt ộ ộ ộ ộ ộ ộ ộ ộ ộ ộ ộ ộ ộ nhiệt ộ

- trạng thái và màu sắc: thực tế trong nhóm halogen, tính chất vật lý biến đổi có quy luật. Đi từ flo đến iot ta thấy trạng thái tập hợp từ thể khí chuyển sang thể lỏng và thắrn, có màu sắc đậm dần.
- nhiệt độ nóng chảy và nhiệt độ sôi: nhiệt độ nóng chảy và nhiệt độ sôi của nhóm halogen tăng dần từ iot io.
- tính tan trong nước: flo không tan trong nước. các nguyên tố thuộc nhóm halogen còn lại tan rất ít trong nước, chủ yếu tan nhiều trong một số dung môi hữu cơ.
-
với dung dịch kiềm loãng nguội:
x2 + 2naoh → nax + naxo + h2o
cl2 + 2naoh → nacl + naclo + h2o
2cl2 + 2ca(oh)2 dung dịch → cacl2 + ca(clo)2 + 2h2o
cl2 + ca(oh)2 bột → caocl2 + h2o
-
riêng flo có phản ứng như sau:
2f2 + 2naoh → 2naf + h2o + of2
-
với dung dịch kiềm đặc nóng:
3×2 + 6koh → 5kx + kxo3 + 3h2o
3cl2 + 6koh → 5kcl + kclo3 + 3h2o (1000c)
tác dụng với muối halogenua
các nguyên tố halogen (ngoại trừ flo – f2) có thể tác dụng với muối halogenua tạo thành muối mới và halogen mới.
x2 + 2nax’ → 2nax + x’2
(x’ là halogen có tính oxi hóa yếu hơn tính oxi hóa của halogen x)
br2 + 2nai → 2nabr + i2
tác dụng với hydro
halogen phản ứng với hydro tạo thành hydro halogenua.
ví dụ: h2 + x2 → 2hx
Điều kiện xảy ra phản ứng với từng nguyên tố halogen như sau:
-
với flo (f2): phản ứng được ngay cả trong bóng tối.
-
với iot (i2): phản ứng có thuận nghịch và phải được đun nóng.
-
với brom (br2): phản ứng xảy ra với điều kiện đun nóng ở nhiệt độ cao.
-
với clo (cl2): phản ứng xảy ra khi được chiếu sáng.
xem thêm: polime: chi tiết khái niệm, cấu tạo, tính chất và ứng dụng
các phương trình điều chế một số nguyên tố trong nhóm halogen
mỗi nguyên tử trong nhóm nguyên tố halogen có cách điều chế khác nhau. một số phương trình điều chế tiêu biểu từng nguyên tố là:
Điều chế flo
pHươNG PHAPP DUY NHấT ể SảN XUấT FLO TRONG Công NGHIệP Là đIệN PHâN HỗN HợP KF Và HF (HỗN HợP ở THể LỏNG), CựC DươNG BằNG (THANN CHYC. ra.
2hf (điện phân nóng chảy+kf) → h2 + f2
Điều chế clo
Để điều chế clo trong phòng thí nghiệm, người ta sẽ cho axit clohidric đặc tác dụng với chất oxi hóa mạnh (có thể là mno2 rắn hoặc kmn4). trường hợp điều chế clo từ mno2 cần xúc tác là nhiệt độ còn với kmno4 có thể đun nóng hoặc không. Clu Clu Thu ược dễ lần với khí hydro chlorua và hơi nước do vậy ể điều chế khí clo nguyên chất, pussy ta sẽc tiếp tục dẫn nó qua bình rửa khh don cóc có chứa hung dg dh dh dh ặ ặ ặ ặ ặ ặ ặ ặ ặ ặ ặ ặ ặ ặ ặ ặ ặ ặ ặ ặ. hơi nước.
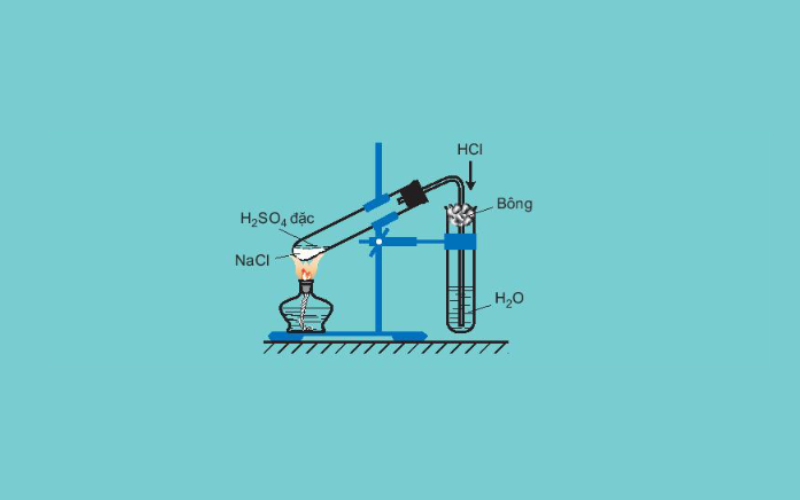
mno2 + 4hcl → mncl2 + cl2 + 2h2o
2kmno4 + 16hcl → 2kcl + 2mncl2 + 5cl2 + 6h2o
strong công nghiệp, người ta điều chế khí clo bằng cách điện phân nóng chảy muối natri clorua hoặc điện phân dung dịch muối có màng ngăn
2nacl → 2na + cl2
2nacl + 2h2o → h2 + 2naoh + cl2
Điều chế brom
trong công nghiệp, brom được sản xuất từ nước biển. sau khi tách nacl ra khỏi nước biển, dung dịch còn lại có hòa tan nabr. tiếp tục dùng khí clo oxi hóa nabr để sản xuất br2.
2nabr + cl2 → 2nacl + br2
Điều chế iot
trong công nghiệp, iot sẽ được điều chế từ rong biển.
cho tác dụng dung dịch với chất oxi hoá để oxi hoá i-thành i2
2nai + cl2 -> 2nacl + i2
Ứng dụng của nhóm halogen trong đời sống
nhóm halogen có nhiều nguyên tố khác nhau và mỗi nguyên tố lại có những ứng dụng nhất ddinhgj trong đời sống. dưới đây là ứng dụng của một số nguyên tố halogen mono tổng hợp để bạn tham khảo:

bài tập về nhóm halogen sgk hóa học 10 kèm lời giải
dựa vào những kiến thức lý thuyết về nhóm halogen ở trên, bạn có thể tự tin làm các bài tập trong sgk để củng cố kiếcn.

bai tập 1 (sgk hóa học 10, trang 96)
kim loại nào sau đây tác dụng với dung dịch hcl loãng và tác dụng với khí cl2 cho cùng loại muối clorua kim loại?
a. faith
b.
c. cup
d.
gợi ý đáp án:
- kim loại zn tác dụng với dung dịch hcl loãng và với khí clo cho cùng loại muối clorua kim loại.
- kim loại sắt tác dụng với dung dịch hcl loãng và khí clo cho 2 loại muối clorua khác nhau là fecl2 và fecl3.
-
nguyên tử chỉ có khả năng jue thêm 1e.
-
tạo ra với hidro hợp chất có liên kết cộng hóa trị có cực.
-
có số oxi hóa – 1 trong mọi hợp chất.
-
lớp electron ngoài cùng của nguyên tử có 7 electron.
gợi ý đáp án:
Đápán là: c. trong tất cả các hợp chất f chỉ có số oxi hóa -1 do f có độ âm điện lớn nhất. các nguyên tố halogen khác ngoài số oxi hóa -1 còn có các số oxi hóa +1; +3; +5; +7
bai tập 3 (sgk hóa học 10, trang 96)
Đặc điểm nào dưới đây là đặc điểm chung của các đơn chất halogen (f2, cl2, br2, i2):
-
Ở điều kiện thường là chất khí.
-
có tính oxi hóa mạnh.
-
vừa có tính oxi hóa, vừa có tính khử.
-
tác dụng mạnh với nước
gợi ý đáp án:
Đáp án đúng là b. nhóm halogen có tính oxi hóa mạnh.
bai 4 (trang 96 sgk hóa 10):
so sanh những nguyên tố halogen về các mặt sau:
a) cấu tạo nguyên tử và cấu tạo phân tử.
b) tính chất vật lí.
c) tính chất hóa học.
gợi ý đáp án:
so sánh những nguyên tố halogen:
mong rằng với những thông tin tổng hợp trên đây bạn đã hiểu hơn về nhóm halogen là gì cùng những tính chất và ứng dụn cúng đi. tiếp tục theo dõi chuyên mục kiến thức cơ bản của monkey để tìm kiếm thêm nhiều thông tin thú vị mỗi ngày. chia sẻ nếu thấy bài tổng hợp trên đây của monkey hữu ích bạn nhé!
-
zn + 2hcl → zncl2 + h2.
zn + cl2 → zncl2.
fe + 2hcl → fecl2 + h2
2fe + 3cl2 → 2fecl3
ag, cu không tác dụng với dung dịch hcl.
bai tập 2 (sgk hóa học 10, trang 96)
Đặc điểm nào dưới đây không phải là đặc điểm chung của các nguyên tố halogen (f, cl, br, i)?
-
-
-
Đặc điểm chung của các nguyên tố nhóm halogen được tổng hợp trong bảng dưới đây:
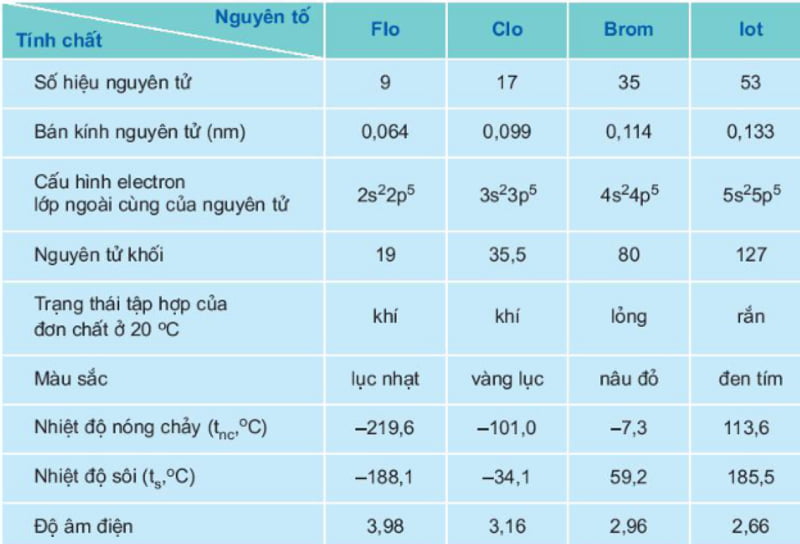
tính chất hóa học của nhóm halogen
vì lớp electron ngoài cùng có cấu tạo tương tự nhau nên các ơn chất halogen tương ối giống nhau về tính chất hóa học cũng như thànhnàh phất phất.

halogen là những phi kim điển hình, đi từ flo đến iot, tính oxi hóa sẽ giảm dần.
các đơn chất halogen oxi hóa được hầu hết các kim loại tạo thành muối halogenua, oxi hóa khí hydro tạo ra những hợp chất khí không màu hydro halogenua. những chất khí này có thể tan trong nước và tạo thành dung dịch axit halogenhidric.
những phản ứng quan trọng minh họa tính chất của nhóm halogen
ể giúp bạn ọc hiểu riqu hơn về các tính chất hóa học của nhó halogen, chún ta sẽ đi vào chi tiết từng phản ứng minh họa cho mỗi tíanh chó:
tác dụng với kim loại
các nguyên tố thuộc nhóm halogen phản ứng hầu hết với các kim loại, ngoại trừ au và pt tạo ra muối halogenua và thường xảy ra ở o nhi. muối jue được thường đạt hóa trị cao nhất của kim loại. riêng phản ứng của nguyên tố halogen i2 với sắt (fe) sẽ tạo ra sản phẩm là fei2 (sắt hóa trị ii).
2m + nx2 → 2mxn
tác dụng với nước
flo tác dụng mạnh với nước, brom và clo có phản ứng thuận nghịch với nước nhưng i ốt thì không có bất kỳ phẻn ứn nƻn vớn v. ta có các phương trình phản ứng như sau:
2h2o + 2f2 → 4hf + o2
h2o + cl2 ↔ hcl + hclo
h2o + br2 ↔ hbro + hbr
tác dụng với dung dịch kiềm
một số nguyên tố nhóm halogen có khả năng tác dụng với dung dịch kiềm loãng nguội và dng dịch kiềm đặc nóng. các phương trình phản ứng tiêu biểu như sau: